细胞治疗的先驱者
以普列威(Provenge)为基石
打造中国细胞和基因治疗产业化加速器

以普列威(Provenge)为基石
打造中国细胞和基因治疗产业化加速器



2022年8月完成DCNP001项目受试者随访。

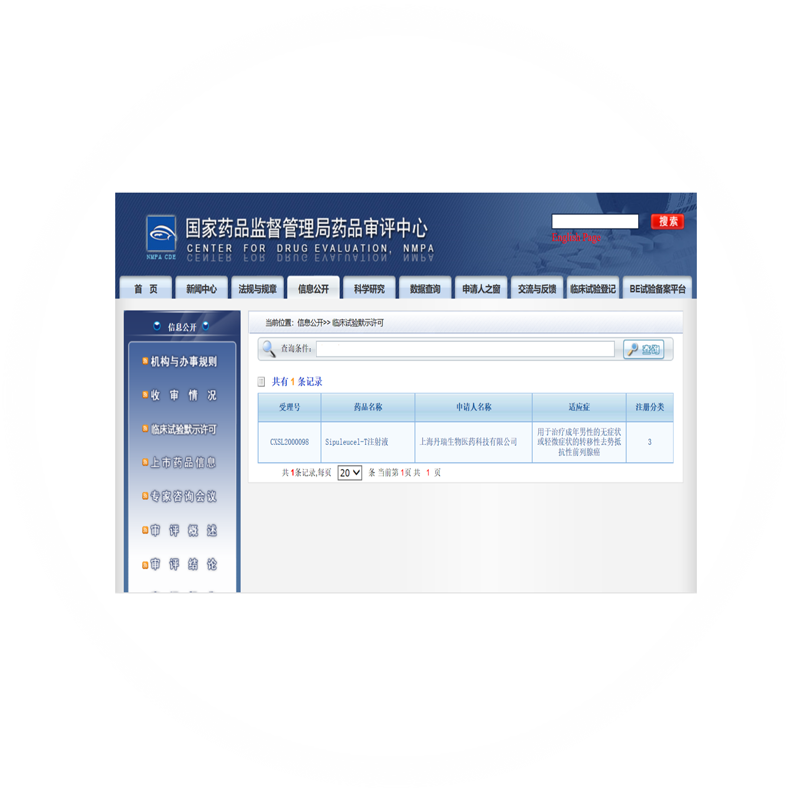
2022年7月28日DCNP002项目于CDE药物临床试验登记及信息公示平台公示。



2022年2月21日普列威关键注册研究DCNP002方案设计获得国家药品监督管理局药品审评中心(CDE)认可。

3月向CDE提交了普列威的临床试验申请,并于8月获批,正式启动国内临床试验。
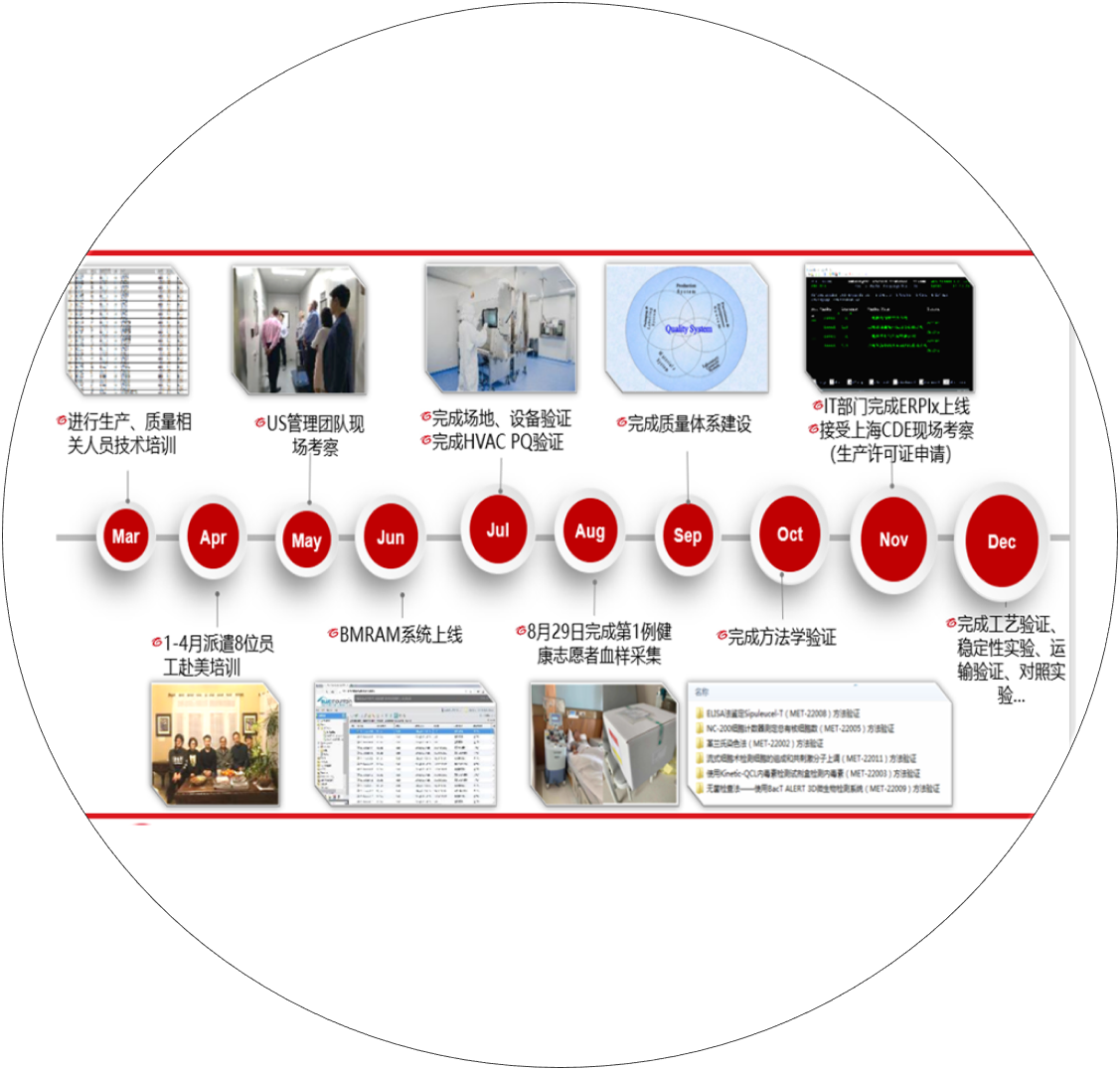

完成全套技术转移工作,包含场地验证、设备设施验证、方法学验证、工艺验证等。

丹瑞中国在上海张江建成国内首个细胞工厂。丹瑞美国和丹瑞中国分别成功注入上市公司南京新百(股票代码:600682)



三胞集团以8.2亿美元收购了(美国丹瑞),完成丹瑞中国注册。

NCCN指南推荐Provenge(Sipuleucel-T)作为(无症状或轻微症状)mCRPC患者的一线用药。



FDA批准了Dendreon的两个细胞工厂,分别在加州的Seal Beach和乔治亚州的Union City。

Dendreon 收到了美国FDA对于Sipuleucel-T的上市批准,并将其命名为Provenge。
Provenge成为了第一个被FDA批准的肿瘤免疫细胞治疗产品。

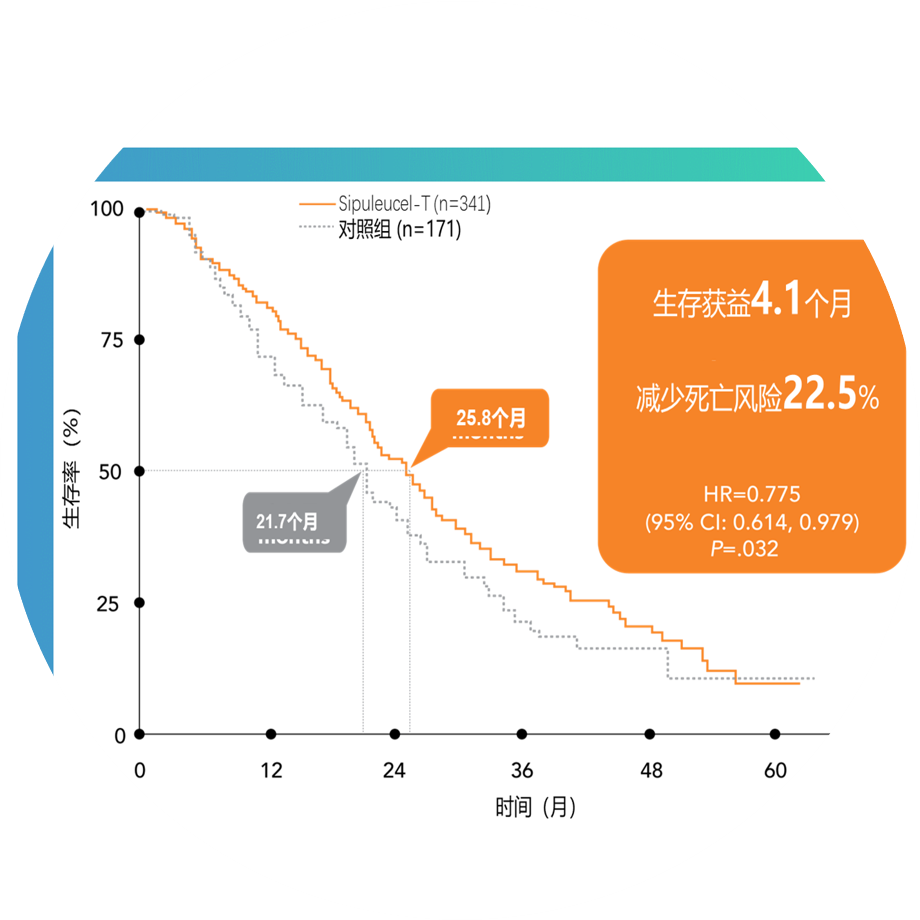

Dendreon完成了Sipuleucel-T的三期临床研究(IMPACT),并公布了研究结果 。

Dendreon的Sipuleucel-T的成分获得了美国专利(专利号6210662)。



ACT公司正式更名为Dendreon。

ACT在位于加州的Mountain View开始了他们的第一家研发工厂。



Edgar Engleman 博士和 and Samuel Strober博士受到他们在斯坦福大学药学院研究成果的鼓舞,建立了Activated Cell Therapy(ACT)公司,这是Dendreon公司的前身。